Рис 3 svpr Модели протрузии
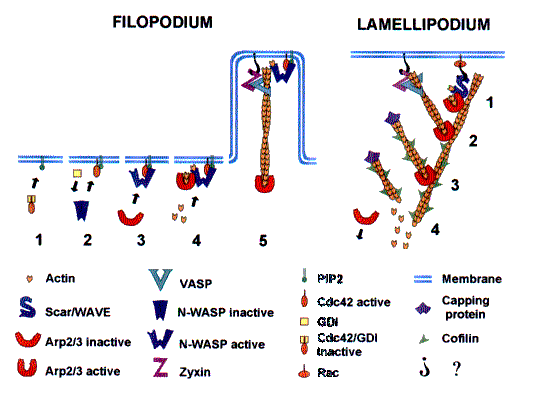
ФИЛОПОДИЯ (слева)
(1) Cdc42 в спокойном состоянии не активен, сигналы (не показаны) стимулируют протрузию.
(2) PIP2 отсоединяет Cdc42 от ингибирующего комплекса GDI (ингибитор диссоциации гуанин нуклеатида, (guanine nucleatide dissociation inhibitor)) и позволяет его ассоциацию с мембраной.
(3) Cdc42 и PiP2 связываются с N-концом N-WASP разрывая внутримолекулярное ингибирующее взаимодействие с его C-концом и направляет N-WASP к мембране.
(4) Экспонированный С-конец N-WASP связывает Arp2/3 комплекс и G-актин, индуцируя конформационные изменения в Arp2/3 комплексе способствуя нуклеации нового филамента.
(5) В процессе последующего удлинения филамента Arp2/3 комплекс диссоциирует от N-WASP но остается ассоциированым с(-)-концом актинового филамента.
Растущий (+)-конец обеспечивает протрузию филоподии. Он удерживается вблизи мембраны посредством VASP, который может скользить вдоль актинового филамента, но жестко ассоциирован с мембраной, возможно при посредстве зиксина и других протеинов.
ЛАМЕЛЛОПОДИИ (справа)
(1) Rac активирует Scar/WAVE и/или направляет его к мембране при помощи неизвестных промежуточных агентов. C-конец Scar/WAVE взаимодействуют с G актином и Arp2/3 комплексом, сидящим на боку другого филамента, индуцируя конформационные изменения в Arp2/3 комплексе (аналогично индуцированному в N-WASP) и образуя новый актиновый филамент под углом 70 градусов.
(2) Острый конец удлиняющегося филамента удерживается вблизи мембраны VASP, зиксином и другими белками. В процессе удлинения Arp2/3 комплекс диссоциирует от Scar/WAVE , но остается ассоциированным с У-соединением, где он предотвращает деполимеризацию с (-)-конца.
(3) После некоторого периода удлинения, (+)-конец блокируется кеппирующим протеином, тогда как другие вновь нуклеированные филаменты продолжают расти.
(4) Диссоциация Arp2/3 комплекса на большом расстоянии от лидирующего края разрешает деполимеризацию с (-)-концов, стимулируемую кофилином.