Стресс и химиотерапия: реакция клеток, P-гликопротеин
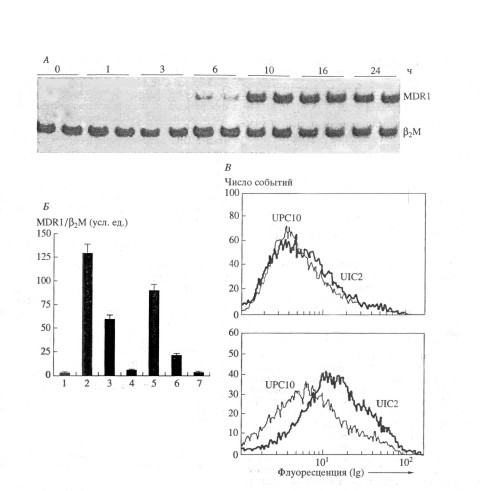
Получены экспериментальные и клинические данные о возможности активации одного из важнейших защитных механизмов - P-гликопротеин (Pgp) - при воздействии на клетки многих агентов, в том числе веществ, применяемых в химиотерапии злокачественных новообразований . Обладая широкой субстратной специфичностью, этот механизм обеспечивает долговременное выживание клеток не только в присутствии конкретного агента; клетки оказываются защищенными и от других веществ, весьма различных по структуре и биологическому действию. Быстрая активация Pgp- опосредованной множественной лекарственной устойчивости (МЛУ) есть компонент общей реакции клетки на стресс . Биологическое значение активации этого молекулярного транспортера состоит в снижении концентрации токсина внутри клетки. Однако, функции Pgp могут оказаться и более широкими.
Кроме того, МЛУ - сложный феномен, обусловливаемый не только Pgp. Многообразные процессы в клетке, например, изменение состава плазматической мембраны, утилизация кислородных радикалов, усиление процессов репарации ДНК, инактивация токсинов системой глутатиона и ферментами лизосом, а также Pgp-независимый транспорт, служат реализации координированного ответа на нарушение гомеостаза. Примеры сочетания активации MDR1/Pgp и других механизмов защиты - повышенная активность ферментов инактивации церамида [ Lucci A., 1999 ] и снижение трансмембранного электрического потенциала митохондрий [ Shtil A.A., Grinchuk T.M., 2000 ] в резистентных клетках. Предстоит выяснить взаимосвязь этих и других феноменов с индукцией или функционированием Pgp. Но поскольку индукция MDR1 происходит в первые часы воздействия экзогенных стимулов, можно предположить, что указанный механизм - один из наиболее ранних. Следовательно, предотвращение Pgp-опосредованной множественной лекарственной устойчивости (МЛУ) будет препятствовать активации дополнительных систем защиты опухолевых клеток и повысит эффективность противораковой терапии.