Трансляция: общие сведения
Трансляция (translation): синтез белка с матрицы мРНК (матричной РНК). (В настоящее время чаще используется термин информационная РНК (иРНК). Процесс, посредством которого генетическая информация с матричной РНК переводится в белок.
иРНК, несущая сведения о первичной структуре белков, синтезируется в ядре клетки. Пройдя через поры ядерной оболочки, иРНК на правляется к рибосомам, где осуществляется расшифровка генетической информации - перевод ее с "языка" нуклеотидов на "язык" аминокислот. Синтез полипептидных цепей белков по матрице иРНК, выполняемый рибосомами, называется трансляцией (лат. translatio - перевод).
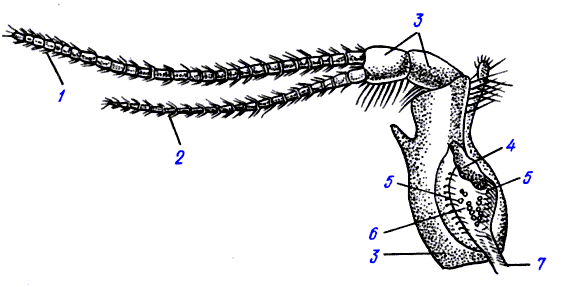
Аминокислоты, из которых синтезируются белки, доставляются к рибосомам с помощью специальных РНК, называемых транспортными ( тРНК ). Эти небольшие молекулы, состоящие из 70-90 нуклеотидов, способны сворачиваться таким образом, что образуют структуры, напоминающие по форме клеверный лист ( рис. 47 ). В клетке имеется столько же разных тРНК, сколько кодонов, шифрующих аминокислоты. На вершине "листа" каждой тРНК имеется последовательность из трех нуклеотидов, комплементарных нуклеотидам кодона в иРНК, - антикодон. Специальный фермент - кодаза опознает тРНК и присоединяет к "черешку листа" аминокислоту - не какую угодно, а только ту, которая кодируется триплетом, комплементарным антикодону. На образование ковалентной связи между тРНК и своей аминокислотой затрачивается энергия одной молекулы АТФ. Для того чтобы аминокислота включилась в полипептидную цепь, она должна оторваться от тРНК. Это становится возможным, когда тРНК поступает на рибосому и антикодон узнает свой кодон иРНК. Ha рибосоме имеется два участка для связывания двух молекул тРНК ( рис. 48 ). В один из этих участков, называемый акцепторным , поступает тРНК с аминокислотой и присоединяется к своему кодону ( рис. 48, I ). Эта аминокислота присоединяет к себе (акцептирует) растущую цепь белка ( рис. 48, II ), между ними образуется пептидная связь. тРНК, к которой теперь присоединен растущий белок, перемещается вместе с кодоном информационной РНК в донорный участок рибосомы . В освободившийся акцепторный участок приходит новая тРНК, связанная с аминокислотой, которая шифруется очередным кодоном ( рис. 48, III ). Из донорного участка сюда вновь переносится оторвавшаяся полипептидная цепь и удлиняется еще на одно звено. Аминокислоты в растущей цепи соединены в той последовательности, в которой расположены шифрующие их кодоны в иРНК.
Когда на рибосоме оказывается один из трех триплетов (УАА, УАГ, УГА), являющихся знаками препинания между генами, ни одна тРНК не может занять место в акцепторном участке. Дело в том, что не существует антикодонов, комплементарных нуклеотидам "знаков препинания". Оторвавшейся в донорном участке полипептидной цепи не к чему присоединиться в акцепторном участке, и она покидает рибосому. Синтез белка завершен.
А начинался он с того, что кодон АУГ , расположенный на первом месте в копии с каждого гена, занимает на рибосоме такую позицию, что с ним взаимодействует антикодон особой тРНК, соединенной с формилметионином. Эта измененная форма аминокислоты метионина сразу попадает в донорный участок и выполняет роль заглавной буквы во фразе - с нее в бактериальной клетке начинается синтез любой полипептидной цепи. В том случае, когда триплет АУГ стоит не на первом месте, а внутри копии с гена, он кодирует аминокислоту метионин. После завершения синтеза полипептидной цепи формилметионин отщепляется от нее и в готовом белке отсутствует.
Для увеличения производства белков информационная РНК часто одновременно проходит не по одной, а по нескольким рибосомам. Такую структуру, объединенную одной молекулой иРНК, называют полисомой . На каждой рибосоме в этом, похожем на нитку бус конвейере синтезируются одинаковые белки ( рис. 49 ). Аминокислоты бесперебойно поставляются к рибосомам с помощью транспортных РНК. Отдав аминокислоту, тРНК покидает рибосому и с помощью кодазы соединяется с такой же аминокислотой. Высокая слаженность всех "служб комбината" по производству белков позволяет в течение нескольких секунд синтезировать полипептидные цепи, состоящие из сотен аминокислот. (См. Регуляция транскрипции и трансляции).
Молекулярные процессы, лежащие в основе синтеза белка, крайне сложны ( Kornberg R.D. et al, 1981 ; McGhee J.D. et al, 1980 ). В синтезе белка участвует три таких класса молекул РНК, как мРНК , тРНК и рРНК. Началом синтеза белка принято считать процесс транскрипции ДНК , в результате которого в ядре должна образоваться соответствующая информационная РНК, которая затем должна перейти в цитоплазму клетки.
Процесс трансляции начинается с присоединения малой рибосомной субчастицы к молекуле мРНК. Особая инициаторная тРНК связывает малую рибосомную субчастицу со специальным старт- кодоном на мРНК . Присоединение большой субчастицы завершает сборку рибосомы .
Далее следует фаза элонгации . Каждая очередная аминокислота (находящаяся в комплексе с tРНК) присоединяется к карбоксильному концу растущего полипептида с помощью циклического процесса, состоящего из трех последовательных этапов: связывания аминоацил-тРНК, образования пептидной связи и транслокации рибосомы. Рибосома перемещается вдоль молекулы мРНК в направлении 5'-> 3' от одного кодона к другому до тех пор, пока не будет достигнут какой-либо из трех стоп-кодонов . К этому стоп-кодону присоединяется затем фактор освобождения , останавливающий трансляцию и вызывающий отделение завершенного полипептида от рибосомы. Энергия для биосинтеза белка обеспечивается гидролизом GTP .
Большинство данных о механизмах биосинтеза белка у эукариот было получено с использованием бесклеточных белоксинтезирующих систем . Важные результаты о механизмах трансляции у эукариот были получены с использованием стабильно трансформированных клеток животных и растений, выращиваемых в культуре. Установлено, что у растений и животных в основном функционируют одни и те же механизмы трансляции.
Клетки животных, кроме основной системы трансляции, локализованной в цитоплазме, имеют дополнительную систему трансляции митохондрий, которая по ряду свойств приближается к бактериальной. Клетки растений обладают дополнительной системой биосинтеза белка, функционирующей в хлоропластах.