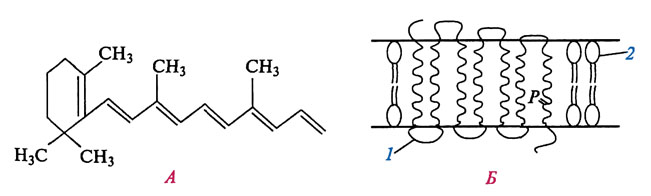
LHBs-Белки
ДНК HBV , интегрированная в геном гепатоцитов , кроме НВх кодирует еще одно семейство регуляторных белков - транскрипционные активаторы PreS2 . Открытая рамка считывания гена preS/S делится на три кодирующих домена: preS1, preS2 и S, альтернативная инициация которых может привести к синтезу оболочечных белков различных размеров: крупных LHBs (PreS1+PreS2+S), средних MHBs (PreS2+S) и малых SHBs (S).
В состав транскрипционных активаторов PreS2 входят белки LHBs (крупные белки оболочки HBV) и MHBst (усеченные в С-терминальной области белки средних размеров). Эти белки проявляют регуляторные функции.
Для представителя активаторов PreS2 - белков LHBs - характерны два варианта их расположения по отношению к мембране [ Prange, 1995 ]. В одном типе белков функционирует первый трансмембранный участок, локализованный на начальном отрезке S-домена (8-21 аминокислот). В этом случае PreS1-PreS2-домен LHBs обращен к просвету ER (эндоцитоплазматического ретикулума). В другом типе белков этот трансмембранный участок не функционирует, причем РrеS1/РrеS2-домен ориентирован в цитоплазму. Как и в случае с белками MHBst , цитоплазматическая ориентация домена PreS1/PreS2 обусловливает регуляторную функцию белков LHBs, и на этом основании их причислили к семейству активаторных белков PreS2 [ Hildt, 1995 ].
Существенное отличие семейства трансактиваторов PreS2 (LHBs и MHBst) от MHBs состоит в том, что они могут подвергаться фосфорилированию под действием РКС (протеинкиназы С). LHBs и MHBst в качестве трансактиваторов инициируют РКС-зависимую активацию сигнального пути c-Raf-1/MEK/ERK (extracellular signal regulated kinase), который является необходимым условием активации транскрипционных факторов AP-1 и NF-kB ( рис. 2 ). В отличие от НВх эта активация не требует присутствия онкогена Ras и сопровождается активацией таких клеточных киназ, как киназа c-Raf и MAP2 .
Для доказательства важности трансактивирующих потенций MHBst in vivo была получена модель трансгенных мышей, продуцирующих в печени один из активаторов PreS2 - MHBst. С помощью этой модели у молодых трансгенных мышей (несмотря на продукцию незначительных количеств белка MHBst) была обнаружена специфическая активация сигнального каскада c-Raf-1/MEK/ERK и усиленная пролиферация гепатоцитов. У этих же мышей в возрасте 15 месяцев и старше была зарегистрирована высокая частота опухолей печени [ Hildt, 2002 ]. У LHBs-трансгенных мышей также наблюдали образование опухолей [ Chisari, 1989 ]. При этом у них была обнаружена чрезмерная продукция белка LHBs, накапливающегося в цитоплазме, с последующим формированием так называемых ground glass-гепатоцитов (т.е. гепатоцитов, характеризующихся гистологическим признаком хронической инфекции HBV и содержащих поверхностные белки вируса в ER). Образование опухолей у этих трансгенных мышей авторы объясняют хроническим воспалением. При этом действие LHBs рассматривается в качестве дополнительного фактора, влияющего на возникновение опухоли.
Таким образом, стресс, связанный с повышенной нагрузкой соответствующим вирусным белком, и воспаление , вероятно, приводят к формированию критических мутации и постоянной активации сигнального каскада PKC-/c-Raf-1/MEK/ERK . Действие обоих факторов, по-видимому, аналогично действию опухолевого промотора в двухстадийной модели канцерогенеза , функция которого заключается в активации широкого спектра ключевых транскрипционных факторов, контролирующих пролиферацию клеток.