Клеточного цикла контроль: введение
Обычно клеточный цикл у эукариот состоит из четырех временных отрезков: собственно митоза ( M ), пресинтетической ( G1 ), синтетической ( S ) и постсинтетической ( G2 ) фаз (периодов). Известно, что общая продолжительность как всего клеточного цикла, так и отдельных его фаз значительно варьируют не только у разных организмов, но и у клеток разных тканей и органов одного организма.
Универсальная теория клеточного цикла предполагает, что клетка как целое в течение клеточного цикла проходит через ряд состояний ( Hartwell L., 1995 ). В каждом состоянии критические регуляторные белки претерпевают фосфорилирование или дефосфорилирование, определяющие переход этих белков в активное или неактивное состояние, их взаимосвязи и/или клеточную локализацию.
Изменения состояний клетки в определенных точках цикла организует особый класс протеинкиназ - циклинзависимые киназы (Cyclin-dependent kinases - cdk ). Cdk образуют комплексы со специфическими короткоживущими белками - циклинами , вызывающими их активацию, а также с другими вспомогательными белками.
Предполагается, что простейший клеточный цикл может состоять только из двух фаз - S и M, регулируемых соответствующими cdk ( Murray A.W., Kirschner M.W., 1989 ). Такой гипотетический клеточный цикл имеет место во время раннего эмбриогенеза у организмов с большими яйцеклетками, например у Xenopus и Drosophila. В этих яйцеклетках все компоненты, необходимые для многочисленных делений, пресинтезированы во время оогенеза и сохраняются в цитоплазме. Поэтому после оплодотворения деления происходят чрезвычайно быстро, и периоды G1 и G2 отсутствуют.
Клеточная пролиферация контролируется сложной сетью внеклеточных и внутриклеточных событий, приводящих либо к инициации и поддержанию клеточного цикла, либо к выходу клеток в фазу покоя .
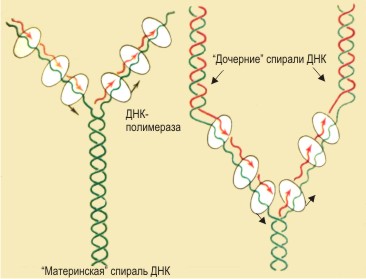
Центральным событием клеточного цикла является репликация ДНК.
Репликация ДНК требует присутствия достаточно большого набора ферментов и белковых факторов, упаковка вновь синтезированной ДНК в хроматин нуждается также в синтезе гистонов de novo. Экспрессия генов , кодирующих перечисленные белки, специфична для S-фазы ( Farnham P.J., Schimke R.T.,1985 , Heintz N., 1991 , Farnham P.L., Slansky J.E., 1993 , Lee H.-H., Chiang W.H., ea., 1995 , Miltenberger R.J., Sukow K.A.,ea., 1995 , Wells J., Held P., ea., 1996 , Dou Q.-P., Pardee A.B., 1996 ).
После завершения репликации, когда генетический материал удвоен, клетка входит в постсинтетическую фазу G2 , во время которой происходит подготовка к митозу.В результате митоза ( М-фаза ) клетка разделяется на две дочерних. Обычно выделяют два критических перехода между фазами- G1/S и G2/M ( Hartwell L., 1995 , Lewin B., 1990 ).
Исходя из схемы клеточного цикла, ( рис. 11-4 ), можно заключить, что клетки останавливались бы в точке рестрикции R в фазе G1, если бы стадия G1 представляла собой биосинтетическую реакцию, намного более чувствительную к ингибированию общего синтеза белка, чем любые другие реакции, специфичные для отдельных фаз цикла.
Было высказано предположение, что для прохождения точки рестрикции R концентрация каких-то триггерных белков должна превысить некоторый пороговый уровень.
Согласно этой модели любые условия, снижающие общую интенсивность белкового синтеза , должны отдалять накопление пороговой концентрации триггерного белка, удлинять фазу G1 и замедлять темп деления клеток. Действительно, когда клетки растут in vitro в присутствии различных концентраций ингибиторов белкового синтеза, клеточный цикл сильно растягивается, тогда как время, необходимое для прохождения фаз S, G2 и М, существенно не изменяется. Наблюдаемое удлинение фазы G1 согласуется с данной моделью, если предположить, что каждая молекула триггерного белка остается активной в клетке лишь несколько часов. Эта модель позволяет также объяснить торможение роста клеток при увеличении их плотности или при голодании; как известно, оба этих фактора снижают синтез белка и останавливают клеточный цикл в наиболее чувствительной точке фазы G1- точке R.
По-видимому, механизмы, контролирующие рост клеток в ткани, воздействуют непосредственно на общую интенсивность белкового синтеза в клетках; согласно этой гипотезе, в отсутствии специфических стимулирующих факторов (и/или при наличии ингибирующих факторов) клетки будут синтезировать белки лишь на некотором базальном уровне, поддерживающем status quo. См белок RB: роль в регуляции клеточного цикла . При этом количество белков со средней скоростью обновления будет поддерживаться на том же уровне, что и в растущих клетках, а концентрация нестабильных белков (в т.ч. и триггерного белка будет уменьшаться пропорционально уменьшению скорости их синтеза. В условиях, способствующих ускорению общего белкового синтеза, количество триггерного белка превысит пороговый уровень, что позволит клеткам пройти точку рестрикции R и приступить к делению.