Гипотеза о сопряжении мт-КК И ТАН
Идея о роли связанной со структурами КК в компартментации АН наиболее полное развитие получила в представлениях о механизме функционирования мт-КК. Как уже было сказано, мт-КК расположена на наружной поверхности внутренней мембраны митохондрии [ Vial, ea 1972 , Jacobus, ea 1973 ] и связана с мембранами силами электростатического взаимодействия [ Липская ea 1980 , Wenger, ea 1985 , Brooks, ea 1987 ]. Вначале предполагалось, что фермент взаимодействует с ТАН , с которой он имеет общие субстраты [ Saks, ea 1975 ]. Однако объемный ингибитор ТАН - карбокси-атрактилозид не влияет на связывание мт-КК с мембранами митохондрии [ Brooks, ea 1987 , Липская ea 1980 , Muller, ea 1985 ]. В дальнейшем были получены многочисленные доказательства того, что мт-КК на мембранах митохондрии связана не с ТАН, а с фосфолипидами [ Липская ea 1980 , Lipskaya, ea 1982 , Липская ea 19?? , Schnyder, ea 1994 ], точнее, с отрицательно заряженным фосфолипидом - кардиолипином [ Muller, ea 1985 , Newman, ea 1982 , Schlame, ea 1985 ]. Сакс и Джекобус [ Saks, ea 1975 , Moreadith. ea 1982 , Jacobus, ea 1982 ] предположили, что высокая эффективность работы мт-КК определяется функциональным сопряжением с процессом окислительного фосфорилирования . По их мнению, функциональное сопряжение обусловлено структурным взаимодействием мт-КК и ТАН, которое происходит во время окислительного фосфорилирования в результате частых соударений при латеральной диффузии этих белков в мембране [ Saks ea 1987 ]. При этом синтезированный в митохондриях АТР с транслоказы прямо передается в активный центр мт-КК, а ADP - в обратном направлении, в результате чего активные центры обоих белков оказываются насыщенными своими субстратами [ Saks, ea 1994 , Saks ea 1987 ].
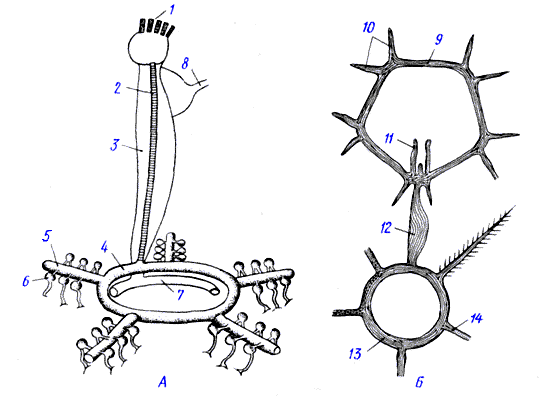
В последние 10 лет эта идея получила развитие в работах Валлиманна и Брдички [ Schlegel, ea 1988 , Schnyder, ea 1988 , Brdiczka, ea 1991 ], которые рассмотрели роль мт-КК в контактных участках мембран митохондрии. Шлегель и со-авт. [ Schlegel, ea 1988 ], а также Шнайдер и соавт. [ Schnyder, ea 1988 ] предположили, что в местах контакта наружной и внутренней поверхностных мембран митохондрии мт-КК вместе с ТАН и белком наружной мембраны порином могут образовывать динамический нуклеотидтранспортный и трансфосфорилирующий мультиферментный канал , осуществляющий прямую связь между матриксом и цитоплазмой ( рис. 2 ). Канал образуется при столкновении в ходе латеральной диффузии по поверхности внутренней пограничной мембраны октамера мт-КК и димера ТАН и стабилизируется взаимодействием с пориновой порой в наружной мембране [ Schnyder, ea 1988 ]. Число димеров ТАН, взаимодействующих с одним октамером мт-КК, может быть равно четырем - восьми [ Schnyder, ea 1988 ]. В местах контакта электронейтральный Кр через катионселективную пору поступает в активные центры мт-КК, расположенные в центральном канале октамера, куда с другой стороны молекулы ТАН передают синтезированный в матриксе АТР. Образованный в креатинкиназной реакции ADP с помощью ТАН переносится в матрикс митохондрии, а КФ диффундирует в цитоплазмy через нерегулируемые поры вне мест контакта. Концентрации АТР, ADP и КФ в канале отличаются от их концентраций в цитоплазме. Это позволяет мт-КК синтезировать КФ даже при высоком отношении КФ/Кр в цитоплазме [ Brdiczka, ea 1991 , Wyss, ea 1992 ]. Варианты этой схемы, различающиеся взаимным расположением отдельных участников и деталями механизма их функционирования, можно найти в обзорах последних лет [ Brdiczka, ea 1998 , Schlattner, ea 1998 ]. Приведенные гипотезы базируются на следующих экспериментально установленных фактах. Гипотеза Сакса-Джекобуса имеет в своей основе данные кинетического и термодинамического анализа. Наиболее часто повторяемыми аргументами являются следующие. Кинетический анализ показал, что скорость синтеза КФ митохондриями во время окислительного фосфорилирования выше, чем в присутствии ингибитора окислительного фосфорилирования олигомицина и внешнего АТР [ Saks, ea 1975 , Saks. ea 1976 ]. Был сделан вывод, что мт-КК быстрее утилизирует АТР, вновь синтезированный во время окислительного фосфорилирования, по сравнению с АТР, добавленным в среду инкубации. Наблюдалось снижение KmMgATP мт-КК во время окислительного фосфорилирования [ Saks, ea 1975 , Saks, ea 1980 ], что было объяснено существованием в области активного центра мт-КК локальной более высокой концентрации АТР. 0,125 М КС1 устранял эффект окислительного фосфорилирования на КmMgATP [ Kuznetsov, ea 1989 ]. Последний факт был объяснен тем, что КС1 солюбилизирует мт-КК в межмембранное пространство и тем самым устраняет функциональное сопряжение [ Kuznetsov, ea 1989 ]. Термодинамические эксперименты показали, что во время окислительного фосфорилирования отношение действующих масс участников креатинкиназной реакции, измеренное в среде инкубации, превосходит Kкаж реакции в направлении синтеза КФ в 2,5-4 раза [ De_Furia, ea 1980 , Saks, ea 1985 , Sobol, ea 1994 ]. Этот эффект был получен на митохондриях [ De_Furia, ea 1980 , Sobol, ea 1994 ] и на митопластах [ Saks, ea 1985 , Sobol, ea 1994 ]. При добавлении в среду инкубации ингибиторов окислительного фосфорилирования или дыхательной цепи, а также в анаэробных условиях эта диспропорция исчезала. Был сделан вывод, что во время окислительного фосфорилирования реальные концентрации АТР и ADP в области активного центра мт-КК отличаются от их концентрации в среде инкубации (в активном центре мт-КК концентрация АТР выше, а концентрация ADP ниже), что и позволяет мт-КК синтезировать избыточное количество КФ и доказывает наличие структурного и функционального сопряжения между мт-КК и ТАН . Было показано также, что антитела на мт-КК ингибируют ТАН, что указывает на близкое расположение двух белков на внутренней мембране митохондрий [ Saks, ea 1986 ]. Гипотеза Валлимана-Брдички базируется, главным образом, на структурных данных. Было установлено, что наружная мембрана митохондрий проницаема для АН только в местах расположения специального белка - порина , димеры которого образуют в мембране аннонселективные поры диаметром около 2 нм [ Colombini, ea 1980 , Roos, ea 1982 , Dolder, ea 1999 ]. Контактные участки наружной и внутренней мембранами митохондрий содержат порин, мт-КК и ТАН [ Brdiczka, ea 1990 , Kottke, ea 1991 ]. Число контактных участков зависит от энергетического состояния митохондрий [ Roos, ea 1982 , Biermans, ea 1990 ]. Проницаемость пориновых пор для анионов в местах контакта зависит от потенциала на внутренней мембране и снижается во время окислительного фосфорилирования, когда поры становятся катионселективными [ Roos, ea 1982 , Benz, ea 1990 ].
В отличие от цитоплазматических форм, которые являются димерами, мт-КК может существовать в виде димера и октамера [ Липская ea 1987 , Schlegel, ea 1988 , Schnyder, ea 1988 , Липская ea 1985 , Marcillat, ea 1987 ]. Октамер мт-КК представляет собой перфорированный куб с центральной полостью диаметром 2-2,5 нм [ Schnyder, ea 1994 , Schnyder, ea 1988 , Fritz-Wolf, ea 1996 ]. Октамер мт-КК может взаимодействовать с наружной и внутренней мембранами митохондрий [ Schnyder, ea 1994 , Rojo, ea 1991 ], а также с димерами порина [ Brdiczka, ea 1994 ].