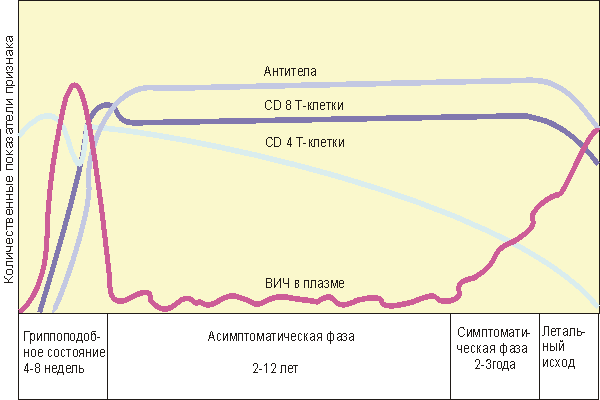
Ядерные поры у высших эукариот: строение и свойства
Ядерная оболочка клеток млекопитающих содержит 3-4 тысячи пор (примерно 10 пор на 1 квадратный мкм) организованных при участии специализированых белков - нуклеопоринов. Через ядерные поры происходит обмен веществами между ядром и цитоплазмой. Действительно, РНК, синтезируемые в ядре, а также рибосомные субъединицы и белки, содержащие сигналы ядерного экспорта , транспортируются через ядерные поры в цитоплазму, а гистоны, компоненты репликативной системы, многие другие белки и U мяРНП (малые ядерные РНП) импортируются через ядерные поры из цитоплазмы в ядро.
Поры окружены большими кольцевыми структурами, называемыми поровыми комплексами (их внутренний диаметр составляет приблизительно 80 нм, а мол. масса -50-100 млн. Каждый комплекс образован набором больших белковых гранул, сгруппированных в октагональную структуру ( рис. 8-20 ,).
Поровой комплекс пронизывает двойную мембрану, связывая по окружности поры липидный бислой внутренней и внешней мембран в единое целое ( рис. 8-20, справа). Несмотря на эту непрерывность, которая должна была бы обеспечивать диффузию компонентов между внешней и внутренней мембранами, они остаются химически разными.
"Дыра" в центре каждого комплекса (ядерная пора) представляет собой водный канал, сквозь который водорастворимые молекулы курсируют между ядром и цитоплазмой .
Ядерный поровой комплекс содержит заполненный водой цилиндрический канал диаметром около 9 нм. Большие ядерные белки взаимодействуют с белками-рецепторами, расположенными на границе ядерных пор, и эти рецепторы активно переносят белки в ядро, увеличивая канал поры.
Ядерные поры - образования массой от порядка 66 мДа у дрожжей до где-то 125 мДа у высших эукариот. Количество белков ( нуклеопоринов ) в составе ядерной поры также варьирует для разных организмов от 30 (приблизительно) у дрожжей, до 50-100 видов белков у высших эукариот. На одно ядро приходится около 190 ядерных пор у дрожжей, 3000-5000 в делящихся клетках человека и порядка 50 миллионов в зрелых ооцитах Xenopus. Впрочем количество ядерных пор зависит от типа клетки, стадии клеточного цикла и конкретной гормональной ситуации. Для ядерной поры характерна симметрия восьмого порядка, поэтому многие белки ядерной поры представлены в ее составе в количестве, кратном восьми ( Gorlich, D., and U. Kutay. 1999 ).
Линейные размеры ядерных пор из разных объектов указаны на рис. 1 . И на цитоплазматической, и на ядерной стороне поры в электронный мокроскоп видны выпуклые кольца. Кольцо, находящееся с ядерной стороны, несет структуру, называемую корзиной (basket). Это образование состоит из обращенных в нуклеоплазму фибрилл и прикрепленного к ним терминального кольца. К цитоплазматическому кольцу также прикреплены фибриллярные белки. К просвету канала обращены восемь симметричных образований (spoke complex), придающих комплексу сходство с восьмиспицевым тележным колесом. Домены этих восьми субьединиц, находящиеся в люмене , по-видимому связываются между собой, закрепляя структуру. В центре комплекса виден вход в канал ядерной поры. Иногда в канале оказывается видна электронноплотная гранула. Некоторые исследователи полагают, что это какой-то транспортирующийся комплекс в момент пересечения ядерной мембраны. Другие считают, что эта структура является функциональной деталью ядерной поры. На основании этого последнего предположения была даже выдвинута неподтвердившаяся впоследствии гипотеза, согласно которой ядерная пора содержит не один, а восемь проницаемых каналов ( Fahrenkrog, B. et. al. 1998 и T. Danker, H. Oberleithner, 2000 ).
Как уже упоминалось, (см. " Нуклеопорины, транспортины, импортины и экспортины ") ядерная пора проницаема для диффузии. Молекулы массой менее 5 кДа, проходят через ядерную пору свободно, и равновесие между ядерной и цитоплазматической концентрацией устанавливается за секунды. Для белков массой 17 кДа этот процесс занимает 2 минуты, белков массой 44 кДа (приблизительно 6 нм) - 30 минут. Белки массой более 60 кДа, по-видимому, вообще не могут пассивно проходить через ядерные поры ( Alberts B., et. al. 1994 ). Проницаемый для гидрофильных макромолекул канал, через который происходит как активный, так и пассивный транспорт, в ядерной поре один, и он, по всей видимости, расположен в центре комплекса ( Feldherr, C. M., and D. Akin. 1997 ). Параметры центрального канала зависят от методов определения. Показания, полученные различными методами и на разных объектах, колеблются в пределах от 6.8 до 13 нм для диаметра эквивалентного канала, и от 15 до 63.5 нм для его длины. Под эквивалентным каналом понимается цилиндрический столб воды, аналогичный каналу ядерной поры по проницаемости для пассивно диффундирующих веществ; то есть эти численные расчеты делались без поправки на свойства белковых стенок канала ( Keminer O, Peters R. 1999 ). Учитывая радиус канала, абсолютно неясно, каким образом проходят через ядерные поры рибосомные субчастицы массой 1.4 и 2.8 МДа. С другой стороны, замечено, что через ядерные поры могут проходить частицы коллоидного золота диаметром до 26 нм ( Feldherr, C. M., and D. Akin. 1997 ).
Методами электронно-микроскопического анализа показано, что ядерная пора довольно лабильная структура, - в ответ на многие стимулы она может изменять свой радиус и, возможно, проводимость. Было обнаружено, что повышение концентрации кальция и ATP могут приводить к уменьшению радиуса ядерной поры и увеличению ее высоты над уровнем мембраны. Поскольку просвет (люмен) двумембранной оболочки ядра непрерывно переходит в богатый кальцием эндоплазматический ретикулум , существует предположение, что выход иона Ca в цитоплазму может играть непосредственную регуляторную роль ( T. Danker, H. Oberleithner, 2000 ). Эта довольно неожиданная теория в какой-то степени дополняется данными о нахождении в составе ядерной поры миозина , сокращающегося белка, функция которого зависит от кальция и ATP ( Berrios M, et. al. 1991 ). В ходе активной транслокации комплекс груз/ транспортины заякоривается на белках ядерной поры.
Аминокислотный мотив, который, как считается, принимает участие в связывании транспортинов в составе комплекса, был найден у многих нуклеопоринов . Этот мотив представлен несколькими повторами последовательности FG , FXFG или GLFG , разделенными спейсерами, длины которых могут варьировать. Показано, что белки, обладающие такими доменами, способны связываться с белками семейства импортинов-бета . У некоторых других нуклеопоринов обнаружена способность связывать GTPазу Ran .
Процесс транслокации субстрата через ядерную пору (для случая импорта) был исследован методами электронной микроскопии с применением частиц коллоидного золота ( рис. 4 ). На основании этих данных процесс можно разбить на несколько стадий. На первой стадии транспортирующийся комплекс заякоривается на обращенной в цитоплазму фибрилле (1). Затем этот филамент сгибается и перемещает комплекс ко входу в канал ядерной поры (2-3). Происходит собственно транслокация и освобождение комплекса в нуклеоплазму (4) ( Pante N., Aebi U. 1996 ).
Ссылки:
- Компартментализованное ядро эукариот
- Рецепторы импорта ядерных белков (импортины)
- Транспорт белков ядерный: избирательность
- Цикл Ran: общее представление
- мРНК: экспорт
- Ядро: структура, введение
- Митоз: образование и распад ядерной мембраны
- Ядро
- Регуляция экспрессии hsp генов на посттранскрипционном уровне
- Ядерный матрикс: определение
- Рис. 32.8(fis). Органоиды нейрона
- Филаменты промежуточные: системы сборка
- мРНК, транспорт в цитоплазму и сплайсинг
- Импорт ДНК-гликозилаз в ядро
- ЯДЕРНО-ЦИТОПЛАЗМАТИЧЕСКИЙ ТРАНСПОРТ