Протеасома
У эукариот протеасомы присутствуют в цитозоле и ядрах, но не в других клеточных органеллах. Протеасомы выделяют в виде индивидуальных частиц с коэффициентами седиментации 20S и 26S. 20S частица является коровой частью 26S частицы , которая обладает протеолитической активностью. Коровая частица представляет собой белковый комплекс в виде цилиндра, через центральный канал которого "протягивается" молекула гидролизуемого белка. В качестве модельного объекта используют протеасомы архебактерии Thermoplasma, которые были закристаллизованы и исследованы с помощью рентгеноструктурного анализа.
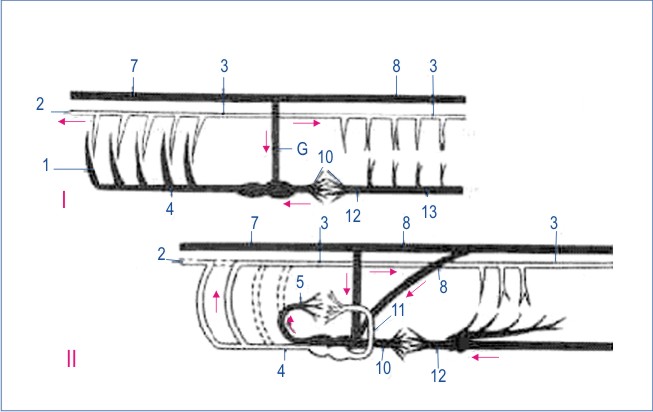
Протеасома Thermoplasma построена из двух (альфа и бета ) субъединиц. Кольцевые структуры на обоих концах цилиндра протеасомы составлены из альфа-, а центральная часть - из бета- субъединиц в отношении альфа7бета7бета7альфа7 ( рис. I.42 ). Протеолитическая активность присуща бета-субъединицам, причем их активные центры направлены внутрь полости цилиндра протеасомы. Кольца альфа-субъединицы по обоим концам молекулы образуют узкие отверстия диаметром около 13 A, через которые может пройти только развернутая цепь полипептида. Это объясняет, каким образом протеасома избирательно расщепляет полипептидные цепи белков, меченные убиквитином. Прежде чем войти в контакт с активными центрами протеиназ, полипептидная цепь деградируемого белка должна быть развернута. Пептиды и аминокислоты, образующиеся в центральной части цилиндра протеасомы, покидают ее через переднее или заднее отверстия, сформированные альфа-субъединицами.
Протеасомы Thermoplasma лишены специфичности в отношении деградируемых белков, и их функционирование требует наличия в N- концевой части бета-полипептидов остатка Thr. Остатки Thr эукариотических бета-субъединиц являются мишенью для антибиотика лактацистина из Streptomyces, который ковалентно связывается с этими остатками, необратимо инактивируя протеасомы.
Локализация активных центров бета-субъединиц внутри протеасомы затрудняет неконтролируемую деградацию окружающих белков.
Субъединицы протеасом синтезируются в виде неактивных предшественников, что предотвращает их преждевременное протеолитическое действие. Подобно тому как ферменты лизосом активируются только после их перемещения в соответствующий компартмент клетки, процессинг бета-предшественников сопряжен с их включением в состав протеасом.
Сборка протеасом начинается с образования гептамерных альфа- субчастиц (альфа7), которые стимулируют аутокаталитическое удаление пропоследовательности предшественника бета-субъединиц, что приводит к их упорядоченной самосборке с образованием гептамерных бета-субчастиц (бета7), состыкованных с альфа- субчастицами. Две предварительно собранные половины протеасомы (альфа7бета7) далее ассоциируют друг с другом с образованием активных 20S протеасом. Очищенные 20S протеасомы эффективно расщепляют небольшие пептиды, но не способны гидролизовать интактные белки. Распознавание конъюгатов убиквитина и разворачивание белковой глобулы происходят с участием около 16 белков, ассоциированных с 20S протеасомой и образующих 26S комплекс. Эти белки способны объединяться в отдельные комплексы, получившие название 19S-кэп-структур . 19S-комплексы ассоциируют друг с другом в присутствии ATP и с 20S протеасомами in vitro, присоединяясь к концам цилиндра.
Протеасомы участвуют в процессинге предшественников с образованием зрелых, активных белков. В частности, процессинг субъединицы p50 транскрипционного фактора NF-kB животных , сопровождающийся отщеплением и деградацией С-концевой части полипептида, происходит с помощью 26S протеасом.
В процессе узнавания антигена T-клетками его разрушение до отдельных пептидов осуществляется с помощью протеасом . Особенностью протеасом, подготавливающих антиген к взаимодействию с молекулами I класса МНС , является наличие в их составе двух субъединиц, которые кодируются генами LMP (англ. low molecular weight protein), локализованными в геноме в МНС ( рис. 3.5 ). Белок Mdm2
Ссылки:
- Прионы и амилоиды: введение
- Фолдинг и системы защиты вновь синтезированных полипептидных цепей от деградации
- Этапы внутриклеточной подготовки антигена
- Амилоидные белки с экспансией полиглутаминовых повторов
- Распознавание антигена T-клетками: заключительный обзор
- Паттерны модификаций хроматина
- Ингибиторы ДНК-топоизомеразы II: общие сведения
- Паркин
- Дендритные клетки: роль в инициации иммунитета
- Убиквитин-зависимая система протеолиза: деградация белков
- Протеолитические ферменты (протеазы): роль в антиоксидантной защите
- p53 Белки: клеточная локализация и концентрация
- Старение и интенсивность обновления белков в клетке
- E3 убиквитин лигаза (паркин)
- PML: поиск дополнительных биохимических функций